7年研究投稿3个月被接收!他们合力改写教科书经典理论
“超乎想象!”《自然》(Nature)审稿人在论文评审意见中说。
中国科学院天津工业生物技术研究所研究员高书山告诉《中国科学报》:“他们(指审稿人)大概都觉得太颠覆了,给我们的评审意见都是这样的调调:你这个文章很好啊,我再给你提一些建议,让它变得更好!”
2024年大概是高书山与杭州师范大学教授郭瑞庭团队的幸运年。从投稿《自然》到被接收,只用了100多天。而很多《自然》发表的论文,通常从投稿到接收需要一年甚至数年时间。
高书山是做麦角生物碱类药物的生物合成机制研究工作的。这篇论文中发现的全新的氧气激活方式堪称改写了教科书经典理论,却是他的科研副产物。这场轰轰烈烈、充满精彩反转的“酶学研究”持续了7年。2025年3月6日,《自然》在线发表了这一成果。

Nature上线论文
意外之喜:“老虎”爱吃“草”
顾名思义,过氧化氢酶EasC的底物是过氧化氢,将其分解为水和氧气,其对底物十分专一,“就像老虎只吃肉” 。而当氧气以底物的身份出现在过氧化氢酶的“食谱”里,对高书山来说是一个巨大的冲击——“老虎什么时候开始吃草了?”
2017年,北京,高书山刚回国,麦角生物碱成为他研究的新起点。麦角生物碱在结构上与人的大脑神经递质受体具有相似性,能够调控人的行为机制,引起人体肌肉收缩,甚至影响人的喜怒哀乐。它被用于治疗孕妇大出血、帕金森病、偏头痛等疾病。高书山团队主攻新药研发,解析麦角生物碱的合成路径是必经环节。
高书山也没想到,做着做着就有了意外之喜。
那年,高书山的团队开展标记实验。他们先是像往常一样,往过氧化氢酶的反应体系里加过氧化氢,可反应速度并没有如预期那般加快。更加荒谬的是,即使不加过氧化氢,这种酶始终能够在空气中推动反应。他们猜测,难道氧气也是它的底物?最终,氧18的喂养带来产物分子量的增加,“老虎吃草”成了活生生的事实。
老虎吃肉、分解肉,这是一个完整顺畅的过程。老虎吃草,又该咋分解草?从专业角度来说,氧气是如何被激活的?
常规流程中,酶的结构里含有一个小分子或金属离子,金属离子相当于中介,可以从还原剂那里得到电子。将电子给氧气,便于其结合到金属离子上被自然激活。简单来说,激活的本质在于还原反应。2018年,承担生化反应的课题组成员姚永鹏却傻了眼——整个反应过程中,还原剂都派不上用场,简直“离了大谱”。既然如此,氧气何以激活?

高书山(左)介绍旋转蒸发仪的操作流程
荒诞的晶体结构令人无法相信
投入多种还原剂、重复实验过程,一做就是两三年,却始终没进展。“这是实实在在做不下去了。”
就在走投无路的时候,高书山去拜访了学术会议上认识的郭瑞庭,提到了这个奇怪的酶。郭瑞庭做酶结构解析已有几十年,具有异常精准的判断力。他说,可以用冷冻电镜技术试试看。这让深耕机理研究的高书山看到了希望。在此之前,他已与多个单位进行过结构解析方面的合作,都未能如愿。
郭瑞庭说,解析酶与底物的复合体结构有两种方法。一个是X射线衍射晶体结构分析,这对蛋白纯化的蛋白体量是否足够、是否能形成排列规则的晶体有相对严格的要求;另一个是单颗粒冷冻电镜技术,虽在条件上相对宽松,但过氧化氢酶只有约90kD大小的酶分子处于电镜技术的分辨率下限。两种技术方式都不一定很适用。
“我们在半年内尝试晶体结构解析技术,没有得到好的结果。转而采用电镜后也需要反复调整样品纯度、浓度和缓冲液条件。”过程虽繁琐,但一年后,郭瑞庭团队成功解析了麦角生物碱合成酶EasC与底物的电镜结构。“算得上十分顺利。”他说。
然而,这一结果让高书山不敢相信。在传统认知中,酶的催化中心通常与血红素直接结合并进行催化反应。而麦角生物碱底物结合区位于独立于血红素结合区之外的一个区域。两个区域相去甚远,在两者之间建立关联,如同在天津发工资、在北京干活儿一般,荒诞、反常,十分不合理。
郭瑞庭却坚信自己的结果肯定没问题。与酶“交手”几十年,郭瑞庭深知每个酶的结构都有其最稳定、最好的方式。这种新的结合模式或许有它自己的“用意”——原本能够结合底物的血红素附近的空间太小了,过氧化氢酶EasC在演化过程中无法直接结合较大的底物产生反应,可能是那里的结构限制了底物结合位的扩大,所以逐渐往另一个空间去变形、另辟蹊径。这一现象,是它走投无路下的必然“选择”。
高书山又翻出来另外一个相似的酶,拿去让郭瑞庭团队做结构分析。“真的做出来了,那我就信!”
结果依旧如此,结合区也在“十万八千里”之外。高书山没有了继续怀疑的底气。他能做的只有搞清楚这颠覆教科书的结构到底是怎么回事。

高书山(前排左六)团队

郭瑞庭(左三)团队
陪老婆散步时的灵光一现
这么一寻思,又是一年。对高书山来说,“脑袋都要想破了”。
他在脑海里逐渐架构起那列来往北京与天津的“高铁”。山穷水尽处,高铁终于“通车”了。
假期,高书山从天津回北京,陪老婆在朝阳公园散步。散步时老婆跟他聊孩子与家务。高书山人在,脑子却不在线。多年前看过的一篇美国化学会的研究综述,突然在他脑中闪现——文献强调超氧阴离子可以在化学反应中作为催化剂,参与多种反应。
“这个超氧阴离子会不会在生物化学反应中也存在?”他大胆猜测,并立马拿出手机,安排学生设计验证实验。
之后的进展非常顺利。他们证实,麦角生物碱底物可以直接提供电子,传递给过氧化氢酶EasC铁离子结合口袋的Fe(III),氧气也的确能够被激活形成超氧阴离子,进而通过一个相当狭窄的超氧阴离子传递通道输送至麦角生物碱底物反应位点。至此,一个全新的、不依赖辅酶-O的非典型氧气激活途径终于形成了逻辑上的闭环。
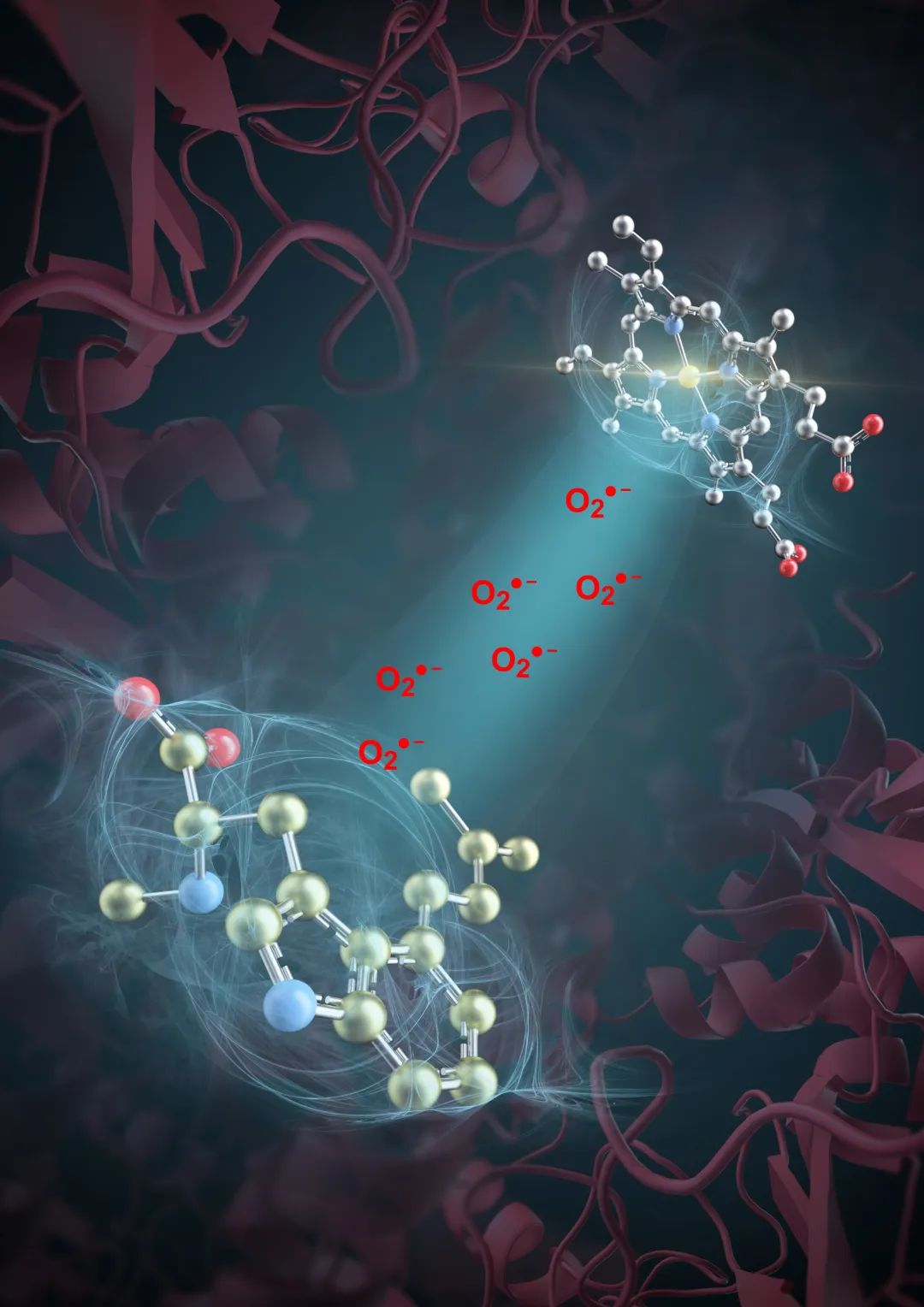
超氧阴离子的生成与传递示意图
“超乎想象”
郭瑞庭有过许多投稿经验,有成功也有失败,却从来没有见过编辑这样积极。2024年8月28日当天接到稿件,《自然》编辑隔天就找到了审稿人进行审核。
10月1日,高书山接到反馈意见。三位审稿人一致同意接收,只提出补充数据、扎实证据的意见,希望文章变得更好。其中一位表示,这篇稿子读来太令人“enjoy(享受)”,文中提到的非典型氧气激活机制实在是“Beyond imagination(超乎想象)”。
12月16日,稿件得到了预接收,整个过程不过3个多月。
前期的沉淀足够长久,这份成果的“过于”顺利也是意料之中。
郭瑞庭几十年来解析过了几百个酶的结构,他早已有稳定的认知框架。对他来说,现在做研究更重视创意、有趣。假如过氧化氢酶EasC并没有一反常态,也不能成为最令他印象深刻的存在。
研究者之间总是有着天然的共情。高书山很清楚,如果没有结构上的完整图景,机理研究的许多工具便难以充分发力,更不要说如何将酶的机理一层一层往下深度剖析。
“京津来往的高铁十分便利,但实际上,这份便利到处存在。”高书山重视研究的首创性,也对这一机制的普适性抱有期待。他觉得,当这一演化机制被更多人了解,不仅对药物合成的效率提升、新药创制有利,还能通过改造酶,使其催化新的反应,对生命科学也有所贡献。
活性更好的麦角生物碱分子或许很快就会得到,但将其研发为新药,不知还要经历几个七年。
相关论文信息:https://doi.org/10.1038/s41586-025-08670-3
文中图片均为受访者提供
| 分享1 |